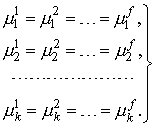
| Публикации: | АСУТП | Теория и технология | Научные работы | Главная |
Металлургическая и горнорудная промышленность. 2002. №10. С.
Рассмотрены вопросы построения моделей для создания автоматизированных систем управления технологическими процессами выплавки и обработки стали в металлургических агрегатах, такие как выбор критериев равновесия, выбор уравнений состояния металла и шлака, учет кинетических сдвигов от термодинамического равновесия, расчет гидродинамики сталеплавильного агрегата.
Система управления, осуществляющая прогноз химического состава и температуры металла, основана на термодинамическом расчете равновесного состава. Для реализации этого подхода необходимо определить критерии равновесия; выбрать уравнения состояния фаз; построить схему решения системы уравнений.
В литературе со ссылкой на Гиббса критерии равновесия выводятся следующим образом. Утверждается, что равновесному состоянию закрытой многофазной системы соответствуют экстремальные значения термодинамических потенциалов системы, например, минимум энергии Гиббса G при условии постоянства соответствующих термодинамических переменных (p и T) и выполнении уравнений материального баланса. Для практического использования этот критерий обычно записывают в виде производных, т.е. в терминах химических потенциалов. Считается, что такая постановка задачи является обычным поиском условного экстремума функции многих переменных при наличии уравнений связи между независимыми переменными (ограничений) в виде равенств, что приводит к использованию метода Лагранжа. В результате получают критерии равновесия в виде равенства во всех фазах температуры, давления и химических потенциалов компонентов, образующих замкнутую систему:
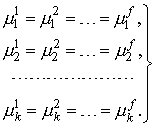 | (1) |
В общем виде проблему можно сформулировать следующим образом. Чтобы найти равновесный состав системы (перечень фаз и количества каждого компонента в них), нужно записать (и затем решить) соответствующую систему уравнений. Но чтобы записать систему уравнений, необходимо знать фазовый состав системы, который станет известным лишь после нахождения равновесного состава системы.
Формальный анализ приведенной выше схемы рассуждений указывает на то, что при составлении функции Лагранжа пропущены условия неотрицательности масс компонентов в фазах (подразумевается, что это и так ясно):
| (2) |
На самом деле, это такие же дополнительные условия (ограничения), как и условия материального баланса, только в виде неравенств, а не уравнений. Учет его в функции Лагранжа послевыполнения описанных выше преобразований приводит к следующей формулировке критериев химического равновесия:
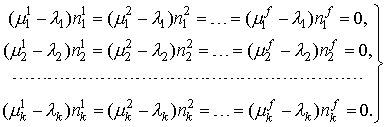 | (3) |
Таким образом, система уравнений (3) является более общим критерием равновесия, чем (1).
Недостаточность (1) проявляется и в других приложениях термодинамики. Например, в методе коллективизированных электронов (МКЭ) предлагается считать компонентами оксидных и солевых фаз химические элементы Периодической системы Менделеева, при этом для такой фазы автор добавляет условие электронейтральности (4):
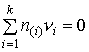 | (4) |
а на основе привлечения дополнительных предположений относительно физической природы шлака в уравнение химического потенциала компонента солевого раствора вводится дополнительное слагаемое (5):
| (5) |
В действительности необходимость введения дополнительного слагаемого и дополнительных предположений относительно физической природы шлака отсутствует. Для этого достаточно учесть, что (4) является обычным дополнительным условием (ограничением), поэтому его необходимо включать в функцию Лагранжа наравне со всеми остальными ограничениями. В простейшем случае (система металл-шлак) получим формулу (6), т.е. формулы МКЭ:
| (6) |
Формулы
Уравнение состояния определяет индивидуальность любой фазы. Многолетний опыт решения практических задач позволил сделать следующий выбор. Термодинамическое состояние элемента в шлаке описывается с помощью теории регулярных ионных растворов В.А. Кожеурова и теории субрегулярных ионных растворов Г.Г. Михайлова с учетом дополнительного вклада энергии мезофазных переходов, что особенно актуально для корректного вычисления активности серы и фосфора в шлаке. Для расчета коэффициентов активности элементов металла выбрана теория субрегулярных растворов. В настоящее время это единственные надежные и широко доступные методы расчета активностей, обеспеченные численными значениями параметров.
Принято, что в сталеплавильных агрегатах основная масса всех поступающих веществ сосредотачивается в жидких металле и шлаке и в газовой фазе. Влияние других фаз (взаимодействие с футеровкой, выделение неметаллических включений (НВ), вынос пыли и т.д.) не оказывает существенного влияния на химический состав жидкого металла. Поэтому основным является расчет равновесия в системе металл-шлак-газ, а состав и количество НВ определяется дополнительным расчетом по результатам вычисления текущего состава металла и шлака.
Расчет производится следующим образом:
В основу расчета гидродинамических процессов положены приведенные ранее принципы, а также уравнение изменения кинетической энергии металла:
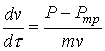 | (7) |
где ![]() – время, с;
– время, с; ![]() – скорость
потоков металла, м/c;
– скорость
потоков металла, м/c; ![]() – масса металла, кг;
– масса металла, кг; ![]() ,
, ![]() – мощность сил трения и перемешивающих сил, Вт;
– мощность сил трения и перемешивающих сил, Вт;
![]() – мощность перемешивания
металла пузырями оксидов углерода (по формуле Кочо);
– мощность перемешивания
металла пузырями оксидов углерода (по формуле Кочо); ![]() – мощность перемешивания металла струей вдуваемого кислорода.
– мощность перемешивания металла струей вдуваемого кислорода.
Исследованиями на основе представленной модели установлено, что произведение ![]() определяет лишь возможность локального «закипания» ванны металла в печи. Характер и интенсивность процесса по всему объему ванны зависит от скорости движения
потоков жидкого металла, которая определяется следующими факторами: начальным содержанием углерода,
интенсивностью ввода кислорода, интенсивностью внешнего перемешивающего действия, геометрическими параметрами ванны.
определяет лишь возможность локального «закипания» ванны металла в печи. Характер и интенсивность процесса по всему объему ванны зависит от скорости движения
потоков жидкого металла, которая определяется следующими факторами: начальным содержанием углерода,
интенсивностью ввода кислорода, интенсивностью внешнего перемешивающего действия, геометрическими параметрами ванны.
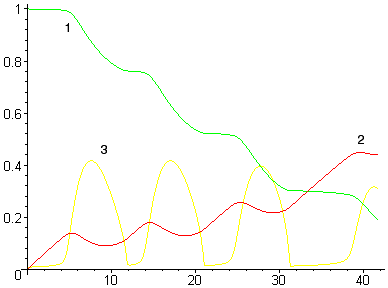
При моделировании ДСП-2 БМЗ без донной продувки поведение металла характеризуется резкими периодическими вскипаниями ванны (см. рис. 1). Содержание кислорода в металле в период вскипания несколько снижается, а между пиками концентрация кислорода нарастает до нового толчка. Кривая скорости потоков соответствует кривой интенсивности кипения.
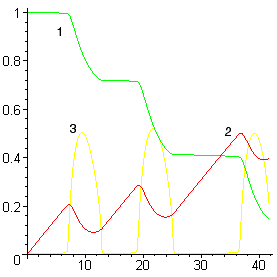
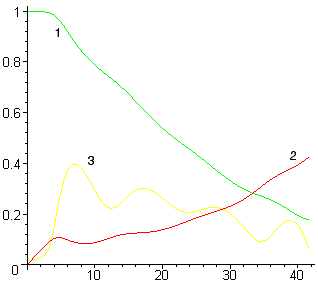
Уменьшение или увеличение интенсивности ввода кислорода (без существенного увеличения мощности перемешивания) принципиально не изменяет качественную картину процесса – ванна периодически вскипает (см. рис. 2а), хотя и с другой периодичностью. Однако при существенном увеличении мощности перемешивания (например, за счет донной продувки инертным газом) кипение переходит в стационарный режим (см. рис. 2б).
Время, мин |
Рисунок 1. Расчет при интенсивности продувки 10 м3/мин.
Цифры у кривых: 1 – ![]() , 2 –
, 2 – ![]() , 3 –
, 3 – ![]() , м/c
, м/c
Время, мин |
Время, мин |
Рисунок 2. Расчет при низкой (а) и высокой (б)
мощности перемешивания
(обозначения см. на рис. 1)
Рассмотренный подход позволяет полностью описать практически любой металлургический агрегат (ДСП, конвертер, сталеразливочный ковш, установка «печь-ковш», промежуточный ковш и т.д.) на основе декомпозиции протекающих в ванне процессов.
На основе проведенных исследований построена компьютерная система автоматического проектирования и управления технологическими процессами в условиях БМЗ и ММЗ, которая прошла промышленное опробование, внедрена и дала существенный экономический эффект, выражающийся в стабилизации режима плавки, снижении продолжительности, расхода электроэнергии и металлолома на тонну годного.
© С.А. Храпко, 2002
| Вверх |